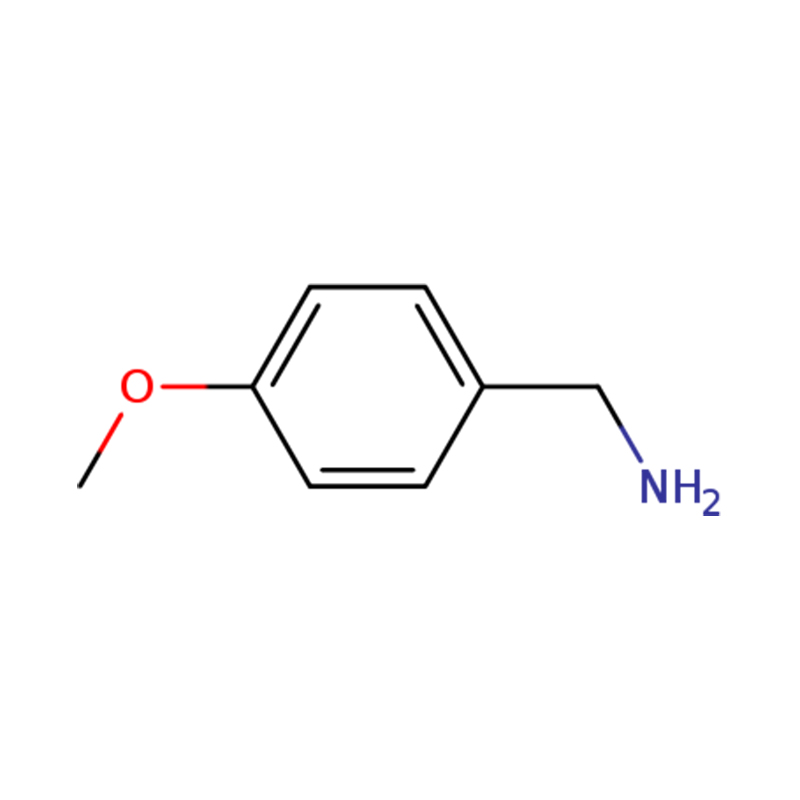
1-(4-МЕТОКСИФЕНИЛ)МЕТАНАМИН
Детаљи производа
| Кас. бр. | 2393-23-9 | Време испоруке | у року од 10 дана |
| Молекуларни | C8H11NO | Производни капацитет | 1 метричка тона/дан |
| Изглед | Бистра, безбојна до благо жута течност | Чистоћа | 99% мин |
| Примена | Фармацеутски интермедијари | Складиштење | Собна температура, тамно, затворено |
| Ограничени број | 1 килограм | Превоз | Ваздух, море, експрес. |
| Густина | 1,05 г/мЛат25°C(осветљено) | Тачка кључања | 236-237°C (осветљено) |
| Тачка топљења | -10°C | Индекс преламања | н20/Д1.546 (дословно) |
| Тачка паљења: | >230°F | Растворљивост | Високо растворљив у води |
| Име | п-анизиламин или (4-метоксифенил)метанамин |
Синоними
ЛАБОТЕСТ-ББ ЛТББ000703; АКОС ББС-00003589; 4-АМИНОМЕТИЛ-АНИЗОЛ; 4-МЕТОКСИБЕНЗИЛАМИН; П-метоксибензиламин хидрохлорид 173,64; 4-метоксибензиламин, 98+%; за спарфлоксацин; П-МЕТОКСИБЕНЗИЛАМИН ХИДРОХЛОРИД
Примена
Може се користити за синтезу фармацеутских интермедијера. Благо је штетан за воду. Не дозволити да неразблажени или велике количине производа дођу у контакт са подземним водама, водотоцима или канализационим системима. Без дозволе владе, не испуштати материјале у околну средину како би се избегао контакт са оксидима, киселинама, ваздухом, угљен-диоксидом, чувати посуду затворену, ставити је у добро затворену посуду и чувати на хладном и сувом месту.
Лабораторија за контролу квалитета
На локацији се налази појединачна лабораторија за контролу квалитета где се спроводе хемијска, физичка испитивања, микробиолошка испитивања, студије стабилности, као и инструментална испитивања као што су IR, UV, HPLC, GC за сировине и готове производе. Читав простор је под контролом приступа и добро се одржава, са довољним бројем аналитичких инструмената за предвиђену сврху испитивања. Сви инструменти су добро обележени и одговарајуће калибрисани.
QA
Одељење за контролу квалитета (QA) је одговорно за процену и категоризацију одступања на већи, општи и мањи ниво. За све нивое одступања, неопходна је истрага ради идентификације основног или потенцијалног узрока. Истрага мора бити завршена у року од 7 радних дана. Процена утицаја производа, заједно са планом за заштиту од несавршености (CAPA), такође су потребни након завршетка истраге и идентификовања основног узрока. Одступање се затвара када се CAPA имплементира. Одступања свих нивоа треба да одобри менаџер за контролу квалитета. Након имплементације, ефикасност CAPA плана се потврђује на основу плана.